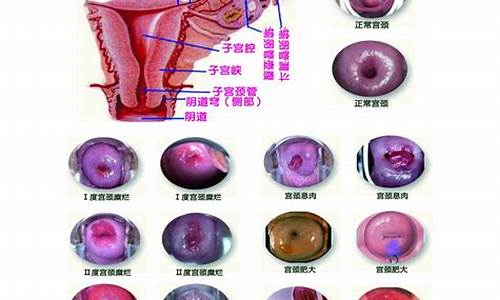
宫颈病的种类_宫颈疾病有哪些及处理原则
1.宫颈癌早期如何治疗
2.什么是宫颈上皮内瘤变?
3.宫颈癌可以治好吗

宫颈原位癌的治疗取决于患者的意愿、年龄、生育要求、依从性、随访条件、就诊医院的设备和技术条件等因素。目前多数学者主张宫颈原位癌的治疗以切除性手术治疗为宜,选择宫颈锥切手术或者子宫切除手术治疗。
1.宫颈锥切术
宫颈锥切既是一种可靠的诊断方法,又是一种有效的治疗手段,因而是宫颈原位癌治疗的首选方法。宫颈锥切后病理检查结果确诊为原位癌者,可以随诊或者4-6周后再行子宫切除;如果病理结果为浸润癌,则需要根据具体情况及早取有效的治疗措施。宫颈锥切常用的方法有冷刀锥切、激光锥切和LEEP锥切术。锥切手术时需要注意:①手术应该在碘染色或者阴道镜检查下进行,以明确病变范围;②切除范围应包括阴道镜下所见的异常病变、整个转化区、全部鳞柱交界及颈管下段,不超过宫颈内口;③切除宽度在病灶外0.5cm,锥高延伸至颈管2-2.5cm。病变在宫颈表面时,锥切宽而浅,若病变累及颈管,锥切应狭而深,避免遗留病灶。另外需要注意患者的年龄,老年女性鳞柱交界向颈管内移动,切除要深,妊娠女性鳞柱交界外移,锥切要浅;④锥切样本需要详细全面检查,必要时标记;⑤宫颈锥切术后如果需要切除子宫,应间隔4-8周为宜。
宫颈锥切术后的并发症主要是出血、感染、颈管狭窄以及宫颈机能不全等。
2.子宫切除术
子宫切除术是切除包含宫颈在内的整个子宫。宫颈原位癌患者如果没有生育要求,应该可以接受全子宫切除。子宫切除术可以直接手术,也可以在宫颈锥切后手术,推荐后者。如果选择直接手术,进行详细的阴道镜评估十分必要。全子宫切除是否需要切除阴道还存在争论,目前多数学者认为原则上应该行筋膜外子宫切除,由于CIS大约存在2-3%的病变累及阴道穹隆,所以阴道切除应该0.5cm,如果病变累及阴道,应该扩大子宫切除。
3.孕期CIS的处理
妊娠女性的CIN病变,75%的患者可以在产后消退,故主张保守观察。由于妊娠期细胞学变化可于产后6周恢复正常,所以产后6周再开始复查,按照非孕期原则处理。对于CINⅢ/CIS的孕妇,应该根据妊娠周数、患者对胎儿要求的迫切程度来决定,原则上不必中止妊娠,也不需要特殊治疗,必须严密随访,包括必要时阴道镜下活检。只有怀疑浸润癌时才行诊断性锥切。虽然多数学者认为孕期锥切时安全的,但是锥切深度不要超过1cm。锥切后若病理仍然诊断为原位癌,可以随访至产后6周再作处理。
4.特殊治疗如果诊断为CIS的患者合并严重的疾病,存在手术禁忌症,可以考虑选择腔内放疗。
宫颈癌早期如何治疗
建议:对于宫颈癌前病变治愈率这个问题一定要重视。你提到宫颈癌前病变治愈率问题,为你
解答如下。1、癌症原则上没有治愈率,只有有效率和5年生存率;
2、手术只是把肉眼看见的肿瘤切除,但癌细胞是切不干净的,复发转移是癌症的特点和规律,术后应该进一步巩固治疗,预防复发和转移;
3、最好用中医中药巩固治疗,看病主要是看医生,最好找专业的、有经验的中医肿瘤专家,根据具体病情,一方面杀伤抑制肿瘤细胞,减轻、缓解、控制病情,既可局部抗癌,又可全身抗癌,另方面可对症治疗,全身调理,提高免疫力,预防复发和转移等。
什么是宫颈上皮内瘤变?
宫颈癌,是严重威胁女性生命的常见疾病之一。对于宫颈癌来说,早期治疗可以挽救女性生命。宫颈癌的早期治疗,可以用手术,也可以放疗,其效果都是不错的。在宫颈癌发病5年内治疗,其有效率达95%左右。
(1)手术治疗:用广泛性子宫切除术和盆腔淋巴结消除。切除范围包括全子宫、双侧附件、阴道上段和阴道旁组织以及盆腔内备组淋巴结(子宫颈旁闭孔髂内髂外髂总下段淋巴结)。手术要求彻底、安全、严格掌握适应征、防止并发症。
(2)放射治疗:一般取用内、外照射结合,内照射主要针对宫颈原发灶及其邻近部位,包括子宫体、阴道上部及其邻近的宫旁组织(“A”)点。外照射则主要针对盆腔淋巴结分布的区域(“B”)点。内放射源用腔内镭(Ra)或137铯(137Cs),主要针对宫颈原发病灶。外放射源用60钻(60Co),主要针对原发病灶以外的转移灶,包括盆腔淋巴结引流区。剂量一般为60Gy,目前对早期宫颈癌多主张先行内照射。而对晚期癌,特别是局部瘤体巨大,出血活跃,或伴感染者则以先行外照射为宜。
无论是手术治疗,还是放射疗法,对于医疗技术、施诊医生要求都很高,所以在就诊时,一定要选择正规专业妇科医院,切不可盲目治疗。
宫颈癌可以治好吗
迄今为止,子宫颈癌仍是危及女性生命的主要疾病之一,尤其在发展中国家发病率高。全世界范围内由其导致的病死率居女性各系统恶性肿瘤的第三位,而居女性生殖系统恶性肿瘤的第二位,仅次于乳腺癌。随着筛查技术的进步和推广,子宫颈癌的发病率和病死率已显著下降,成为肿瘤防治的典范。子宫颈癌发病率和病死率的降低,相当程度上得益于对子宫颈癌前病变——子宫颈上皮内瘤变(CIN)的识别和合理有效的早期干预。
(1)子宫颈上皮组织学基础。子宫颈组织学的特殊性是子宫颈上皮内瘤变的病理生理学基础。子宫颈上皮由子宫颈阴道部的复层鳞状上皮和子宫颈管的单层柱状上皮组成。子宫颈上皮的特殊性在于其受各种生理、病理因素的影响而处于动态变化之中。
①原始鳞状上皮。被覆宫颈阴道部的复层鳞状上皮,与阴道穹窿上皮相连续,大约20 层细胞,可分为3 层。
底层:又称生发层,内底层为单层柱状细胞,呈栅栏状排列在基膜上;外底层又称深棘层,为数层卵圆形细胞,核较大。免疫组织化学显示底层细胞含有表皮生长因子受体、雌激素受体和孕激素受体,为储备细胞,在某些因素的刺激下可以增生或化生,也可以增生成为不典型的鳞状细胞或分化为成熟的鳞状细胞。
中层:又称浅棘层,细胞多边形或梭形,胞浆多而淡染,含糖原多则透明,核相对较小。
表层:细胞扁平,核浓缩,胞浆嗜酸性。
②宫颈柱状上皮。为单层分泌黏液的高柱状上皮,少数细胞有纤毛,核卵圆形位于细胞的下1/3 。基底部散在少数储备细胞。被覆宫颈管的内表面,或伸至宫颈阴道部,有绒毛状突起,并向基质内形成裂隙或腺体。
③转化区。子宫颈鳞状上皮与柱状上皮交接部成为鳞- 柱交接。
根据其形态发生学变化,鳞- 柱交界又分为原始鳞- 柱交接部和生理性鳞- 柱交接部。
原始鳞柱交界(OSCJ):为原始鳞状上皮与宫颈管柱状上皮的交界。该交界在胚胎20 周即形成,位于宫颈外口阴道段。
生理性鳞- 柱交接部即新鳞柱交界(NSCJ) :为化生的鳞状上皮的内周与柱状上皮会合之交界。新鳞柱交界随年龄、性激素水平等向内外变化,绝经后新鳞柱交界可以上延至宫颈外口内而不易看到。青春期无性生活者,原始鳞柱交界无大变化,宫颈口外多为正常柱状上皮;有性生活刺激者,宫颈口外多为化生上皮。妊娠期宫颈扩张,柱状上皮外翻,产后愈合;老人的OSCJ 不清,NSCJ 可伸向颈管内。
原始鳞- 柱交接部和生理鳞- 柱交接部之间的区域称为移行带。
在移行带形成的过程中,其表面被覆的柱状上皮逐渐被鳞状上皮所替代。其替代机制为鳞状上皮化生和鳞状上皮化。移行带内成熟的表面上皮对致癌物的刺激不敏感。但未成熟的表面上皮在一些物质的刺激下,可发生异型变,形成子宫颈上皮内瘤变和癌变。
④表面上皮。由原始鳞柱上皮交界处的柱状上皮逐渐转化成的鳞状上皮。宫颈的单层柱状上皮比较脆弱, 暴露于阴道酸性环境或受不良刺激,其下的储备细胞增生,逐渐转化为鳞状上皮。开始时未成熟的表面上皮细胞核大密聚,染色浅、只有6 ~ 10 层细胞,上皮薄。随着化生上皮的逐渐成熟,细胞层次增多、上皮增厚,细胞富含糖原。
⑤不成熟表面上皮。转化区内的柱状上皮在化生早期未成熟时,细胞多层,胞浆少,密度较大。当分化与极性不明显时,须注意与非典型增生、原位癌鉴别。此区为阴道镜检查最重要的靶区。
⑥非典型增生上皮。单层柱状上皮在阴道内受酸性环境刺激或致癌因子打击,在化生的基础上细胞分化与成熟发生障碍,并出现非典型性。从幼稚的基底细胞向上增生伸展,细胞核增大,不规则,核染色质增多,核分裂活跃,核/浆比值增大,在一定程度上与癌细胞相似。
(2)CIN 的病理学。1967 年Richart 提出子宫颈上皮内瘤变的概念并很快得到国际公认,将宫颈上皮内瘤变(CIN)作为宫颈癌前病变的统一名称,它反映了子宫颈癌发生发展的连续过程。CIN 的病理特点是局限于子宫颈鳞状上皮层的瘤变,表现为细胞排列异常和核异常。
子宫颈上皮内瘤变可分为3 级。
CIN Ⅰ级:相当于病理学上的轻度非典型增生,不成熟的异形细胞局限于上皮厚度的下1/3,表现为细胞核增大,核质比例略增大,核染色质稍加深,核分裂相少,细胞极性紊乱。
CIN Ⅱ级:相当于中度非典型增生,不成熟非典型细胞局限于上皮的下2/3,表现为细胞核明显增大,核质比例增大,核深染,核分裂相较多,细胞数量明显增多,细胞极性尚存。
CIN Ⅲ级:包括重度非典型增生和原位癌,前者上皮全层几乎都为不成熟非典型细胞,但表层细胞的密度稍低或可见1 ~ 2 层与表面平行的扁平细胞。
原位癌(CIS):整个鳞状上皮都由紧密排列的未分化的非典型细胞组成,有时混有不同程度的分化性细胞,但有显著的多形性;基底膜完整,上皮与结缔组织之间分界明显,可沿基底膜累及腺体。
原位腺癌:宫颈管表面小灶柱状上皮或单腺管癌变,未突破基底膜。细胞复层化,显著异型,胞浆少,核大深染,多形性,核分裂多见,与正常柱状上皮分界清楚。
(3)CIN 的病因。流行病学研究发现,CIN 的发生与社会经济状况、性行为、性伴性行为、口服避孕药、吸烟、营养状况和月经分娩史等危险因素密切相关。目前研究最多,认识也最一致的生物学病因是人乳头瘤(HPV)感染。从20 世纪70 年代中期开始,HPV 与子宫颈上皮内瘤变关系的研究日益增多,HPV 在子宫颈病变产生过程中的关键作用逐渐明确。研究表明,大约80% ~ 90% 的CIN 有HPV 的感染。通常HPV 感染后约经12 个月大多被清除而转为阴性,仅少数成为持续感染状态,此时HPV-DNA 片段可整合到宿主细胞DNA 组,进而引起宿主细胞发生恶性转化。
目前,已经发现HPV 有近300 个血清型。根据其与宫颈癌发病相关性而将其分为高危型和低危型。HPV16、18、31、33、35、39、45、51、52、56 和58 为高危型,可诱发癌变。CIN Ⅰ主要与HPV 亚型6、11、31 和35 等感染有关, 而CIN Ⅱ、Ⅲ 则主要与HPV16、18、33 等高危型有关。高危型HPV 亚型可产生两种癌蛋白:
E6、E7。E6、E7 与宿主细胞(如宫颈储备细胞)的细胞周期调节蛋白(如p53、RB 等)结合,导致细胞周期控制失常而发生癌变。目前美国默沙东公司和葛兰素史克公司分别研制出HPV 感染预防性疫苗已上市:HPV4(四价疫苗,针对6、11、16、18 型,适用于9 ~ 26岁女性及男性,FDA 核实可预防外阴阴道、肛周癌症)和HPV2(二价疫苗,针对16、18 型,适用于10 ~ 25 岁女性,在性生活开始前接种,是最为有效的预防方式)。有研究报道:HPV 疫苗接种3 年后,对既往无16、18 型HPV 感染的女性,防止16、18 型HPV 感染引起CIN2/3 的有效率为99%,但对已有感染女性的有效率仅为44%。
有研究显示四价疫苗效果可持续5 ~ 9.5 年。治疗性疫苗仍处于临床Ⅰ - Ⅱ期。
(4)CIN 的临床表现及其转归。临床上,子宫颈上皮内瘤变常无特殊症状。常表现为阴道分泌物增多、色黄或异味。偶为接触性出血,常发生在性生活或妇科双合诊或三合诊检查后出血。妇科体检时可见子宫颈表面无明显病灶或仅见子宫颈局部红斑、白色改变,或子宫颈糜烂等慢性宫颈炎的表现。
研究表明,子宫颈上皮内瘤变的发生发展过程是一缓慢而可变的过程,其过程可达十几年之久,并可发生自然消退或逆转。有作者认为HPV 型别和CIN 级别是决定CIN 转归的重要因素。HPV6、11 型等低危型引起的病变易于逆转,而HPV16、18 等高危型引起的病变自然消退或逆转的概率则较低。CIN Ⅰ、Ⅱ中70% 以上可自然消退或维持不变,约30% 进展为CIN Ⅲ,而CIN Ⅲ进展为浸润癌的概率高达40%。虽然只有少部分的CIN 有可能进展为宫颈癌,但目前我们没有一个可靠的指标来预测什么样的病变能够自然消退。
(5)CIN 的诊断。临床上CIN 常无特殊表现,其诊断主要依据病理学检查。现在,随着检查技术的进步,一些检查手段有助于提高病理学检查的准确性和针对性。
①肉眼检查(VIA) 。肉眼检查是指在宫颈表面涂化学溶液,在没有放大的条件下,凭医生肉眼直接观察宫颈表面上皮对染色的反应,以诊断宫颈病变。肉眼检查是一个相对简单,较少依赖操作设施的方法,但灵敏度和特异度均相对较低,大约分别在50%~ 70%和85%之间。检出的病例大部分并非是早期病变。由于对操作人员易于培训、费用低廉和快速可行,适于大人群筛查,在经济不发达地区仍具有推广前景和实用价值。
②子宫颈细胞学检查(巴氏涂片和TCT)。子宫颈刮片细胞学检查为最简单而有效的发现子宫颈上皮内瘤变的检查方法。自从20 世纪40 年代应用于临床以来,在子宫颈癌及癌前病变的防治中发挥了重要作用,已使子宫颈癌的病死率下降了近70%。但传统的巴氏涂片技术有一定的误诊及漏诊率,且有高达50% 的阴性率而使这一技术受到了挑战。为克服巴氏涂片技术存在的问题,近年来一些新技术开始在临床推广,如ThinPrep 和AutoCyte Prep 两种薄层液基细胞学技术。液基细胞学改变了常规涂片的操作方法,标本取出后立即洗入装有特殊细胞保存液的容器中,几乎保留了取材器上的所有细胞。因细胞是均匀分散于样本中,与常规巴氏涂片方法比较,提高了样本的收集率并使细胞单层均匀地分布在玻片上。
在制片过程中,去除了血液、黏液及过多炎性细胞的干扰,避免了细胞过度重叠。玻片上的不正常细胞容易被观察,并且使固定的细胞核结构清晰、易于鉴别,识别高度病变的灵敏度和特异度分别为85%和90%左右。与巴氏细胞学涂片技术相比,使发现低度和高度病变的敏感度提高10%~ 15%。
细胞学自动阅片系统PAPNET,克服了传统的人工读片费时、一致性差等缺点,可用于细胞学诊断及筛查的质控。PAPNET 对传统巴氏涂片或液基细胞学技术制片在全自动显微镜下进行电脑扫描,每例选出128 幅含有相对“异常”细胞的图像,刻制在光盘上,供细胞病理学工作者阅读。阴性涂片可通过PAPNET 检测出来。提高了细胞病理学家的工作效率和准确性。
美国肿瘤学会1988 年提出的Bethesda 系统经过两次修改后,使诊断术语更加规范和一致。Bethesda 系统,简称TBS,强调标本质量评估的重要性,为各种癌前病变提供标准化可重复的标准和术语,以达到降低不同观察者之间的差异,与临床医生进行有效的交流,有助于形成统一的、规范的处理方式,该报告系统还提出建议,使临床医生知晓随后的处理步骤。
③ HPV 检测。检测方法很多,如细胞学、斑点印迹、原位杂交、PCR 以及杂交捕获法(HC2)以及新一代cobas 4800 HPV test(它有三个结果:HPV16/18,以及其他12 种高危类型的合并结果);高危型HPV 检测和16/18 型HPV 检测是两种不同的方法。初筛时仅使用前者(检测14 中高危HPV 中任何一种是否存在),而后者(检测HPV16 或18 是否存在)仅用于前者异常时决定后续处理。高危型HPV DNA 现今以HC-2 最佳,其检测的敏感性为88% ~ 100%,特别是阴性预测值高达99%。目前,高危HPV 检测不应作为单独的筛查项目,并不能取代细胞学检查和妇科检查等项目,因为HPV 感染常是一过性的,只有持续感染才会导致宫颈癌。
④阴道镜检查。阴道镜通过对被检组织的放大观察,可了解病变区域血管、上皮的形态和分布等细微情况。对细胞学可疑或阳性者行阴道镜检查,可进一步确定病变的部位和大小范围,通过阴道镜对细微结构的观察,使活检目标更具准确性,对其病变性质进行区分,提高活检的阳性率。达到早期筛查早期诊断。阴道镜观察主要以病灶的边界形态、颜色、血管结构和碘反应四个征象反映病灶的异常。
⑤子宫颈活组织检查。子宫颈活组织检查是确诊子宫颈上皮内瘤变的最可靠方法。任何肉眼可见或阴道镜下病灶均应做单点或多点活检。多点取材或在碘试验阳性区取材,可提高准确性。
⑥宫颈管搔刮术。宫颈管搔刮术也是活组织检查的方法之一。
子宫颈上皮内瘤变不仅发生在子宫颈阴道部表面,还可来源于宫颈管柱状上皮或鳞状上皮内瘤变向宫颈管蔓延,而阴道镜只能观察子宫颈表面的病变情况而不能了解子宫颈管的病变情况。因此,应刮取子宫颈管内组织作病理学检查。
(6)CIN 的治疗。治疗方法的选择主要取决于CIN 的级别、病变范围、患者年龄以及对生育的愿望等。随着CIN 和早期子宫颈癌的深入研究和认识提高,治疗前必须注意以下几个问题:治疗前诊断必须明确,必须排除浸润癌;宫颈管刮术病理阴性或颈管病灶表浅;治疗时间最好在月经干净5 ~ 7 天内,并在阴道镜和碘试验下进行操作;治疗范围须包括全部病灶、整个转化区和颈管下段;治疗深度足够;治疗后必须定期随诊,包括细胞学、阴道镜和病理,有条件者可包括HPV-DNA 检测。保守治疗的常用方法包括电烙、电凝、冷冻、激光及超声聚焦;手术治疗包括LEEP、宫颈锥切术及全子宫切除等。
① CIN Ⅰ 阴道镜检查满意、活检确诊的CIN Ⅰ中,近达70%的病变可自然消退或维持不变,进展为浸润癌的机会极少,目前推荐此类病变可仅作随访观察即可,无需积极干预治疗。但对于细胞学结果为不典型腺上皮细胞(C),宫颈管刮的病理也为CIN Ⅰ甚至更高级病变,应予以宫颈锥切术,明确诊断。
② CIN Ⅱ、CIN Ⅲ的病灶持续率和进展率均显著高于CIN Ⅰ。
研究表明,未经治疗的CIN Ⅱ,大约43% 可自然逆转,35% 持续存在,而22% 将进展为原位癌或浸润癌;而未经治疗的CIN Ⅲ,仅32% 发生自然逆转,56% 持续存在,而进展率高达14%。因此,大多数学者主张对组织活检证实的CIN Ⅱ、Ⅲ均应进行积极治疗。治疗方法的选择:如阴道镜检查满意,排除了浸润癌,冷冻、激光汽化、电凝、超声聚焦或LEEP、激光锥切和冷刀锥切等切除性手术均可用;阴道镜检查不满意者,应行诊断性切除手术。属复发者主张行LEEP、激光锥切或冷刀锥切手术。以往盛行的子宫切除术已经不再作为首选治疗方法。
③诊断性切除手术后切缘或宫颈管残留CIN 者,可于术后4 ~ 6月随诊时行阴道镜检查和宫颈管刮术,一旦残留病灶诊断为CIN Ⅱ或Ⅲ,大多主张再次行切除性手术。如再次手术困难或组织活检证实复发/ 持续存在的病灶为CIN Ⅱ、Ⅲ,也可考虑行子宫切除术。
(7)妊娠期宫颈病变处理原则。
①在妊娠期,阴道镜的建议和后续的处理跟之前的概述总体一致。
②巴氏细胞学在妊娠期是安全的,ECC 不建议施行。
③阴道镜和宫颈活检仅限于高级别病变或疑似浸润癌的女性.④ LSIL 和ASC-US 可延迟至产后6 周处理。
⑤ ASC-H,HSIL,C 或AIS 在妊娠期最少需要阴道镜来评估。
⑥任何级别的CIN 病变的治疗均应在产后。
⑦ AIS,微小浸润或浸润癌需妇瘤专家会诊,与患者沟通。不应按常规延迟到产后来处理。
⑧诊断性切除仅推荐在疑似浸润癌时。
宫颈癌可以治好,早期治疗预后较好。与临床期别、病理类型等密切相关。有淋巴结转移者预后差。宫颈腺癌早期易有淋巴转移,预后相对较差。宫颈癌是最常见的妇科恶性肿瘤。原位癌高发年龄为30~35岁,浸润癌为45~55岁,近年来其发病有年轻化的趋势。
近几十年宫颈细胞学筛查的普遍应用,使宫颈癌和癌前病变得以早期发现和治疗,宫颈癌的发病率和死亡率已有明显下降。
扩展资料:
病因可能与以下因素相关:
1、感染:高危型HPV持续感染是宫颈癌的主要危险因素。90%以上的宫颈癌伴有高危型HPV感染。
2、性行为及分娩次数:多个性伴侣、初次性生活<16岁、初产年龄小、多孕多产等与宫颈癌发生密切相关。
3、其他生物学因素:沙眼衣原体、单纯II型、滴虫等病原体的感染在高危HPV感染导致宫颈癌的发病过程中有协同作用。
百度百科-宫颈癌
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。